
Durcissement structural des alliages de bijouterie.
Le durcissement que peuvent présenter certains alliages de bijouterie a l’avantage de permettre la réalisation de pièces légères mais de résistance à l’usure intéressante. Ce traitement de durcissement doit être effectué sur le bijou fini. En effet, un alliage trop dur sera difficile à travailler donc il faut lui garder sa plasticité pour le déformer selon ses besoins. Ce n’est qu’au stade final qu’il est avantageux de lui conférer la dureté nécessaire à sa meilleure conservation possible.
La structure des métaux à l’état solide.
Pour comprendre le durcissement structural, il faut se pencher sur l’élaboration des alliages et les phénomènes de solubilité des différents éléments. Les métaux purs sont en général trop mous pour être utilisés tels quels et sont mélangés entre eux pour former des alliages.
Un alliage est obtenu en fondant les éléments constitutifs, en les portant à une température suffisante pour atteindre l’état liquide, puis en refroidissant le mélange jusqu’à la température ambiante. Le solide ainsi obtenu est un alliage.
La structure de l’alliage dépend de ses métaux purs constitutifs et de la température à laquelle on se trouve.
A l’état liquide, les métaux ont souvent une certaine miscibilité entre eux. Cette miscibilité diminue lorsque la température baisse vers l’état solide et peut encore varier lorsque la température du solide change.
Ex : Solubilité totale : Alliage Or – Argent (Au-Ag)
♦Quelle que soit la quantité d’or que l’on ajoute à l’argent elle sera absorbée comme lorsque l’on mélange de l’eau et du vin.
Lorsque le mélange est effectué, les atomes de chacun des éléments ne peuvent plus être distingués les uns des autres au niveau macroscopique (et ne peuvent plus être séparés les uns des autres). Ceci est valable à l’état solide quelle que soit la température à laquelle on se trouve.
On appelle cette structure une solution solide complète.
Ex : Insolubilité totale ⇒ Alliage Argent Nickel (Ag-Ni)
♦Quelquefois les éléments sont totalement insolubles l’un dans l’autre, même à l’état liquide, comme l’argent et le nickel. Au refroidissement à l’état solide, on retrouvera une juxtaposition de particules de chacun des éléments constitutifs à l’état pur.
Tout se passe comme un mélange d’eau et d’huile qui a été agité. On peut former une émulsion mais elle finit par se scinder en huile et eau avec le temps.
Ex : Solubilité partielle ⇒ Alliage Argent – Cuivre (Ag-Cu)
♦Certains alliages présentent à l’état solide une solubilité partielle des éléments comme l’argent et le cuivre.
L’argent peut dissoudre une certaine quantité de cuivre et réciproquement. En fait, tout se passe comme s’il y avait une démixtion qui aurait dû se produire à une température où l’alliage est encore liquide.
La solubilité augmente en général avec la température. Elle est spécifique à chaque système.
La majorité des alliages précieux de bijouterie ont des structures différentes suivant le domaine de température dans lequel ils se trouvent, ce qui permet d’envisager le durcissement structural.
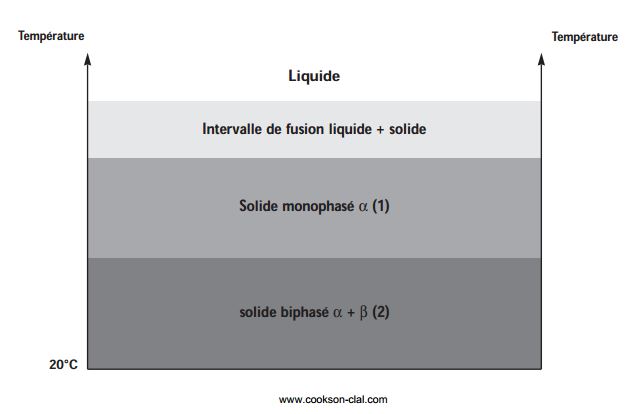
Figure 1
Le durcissement
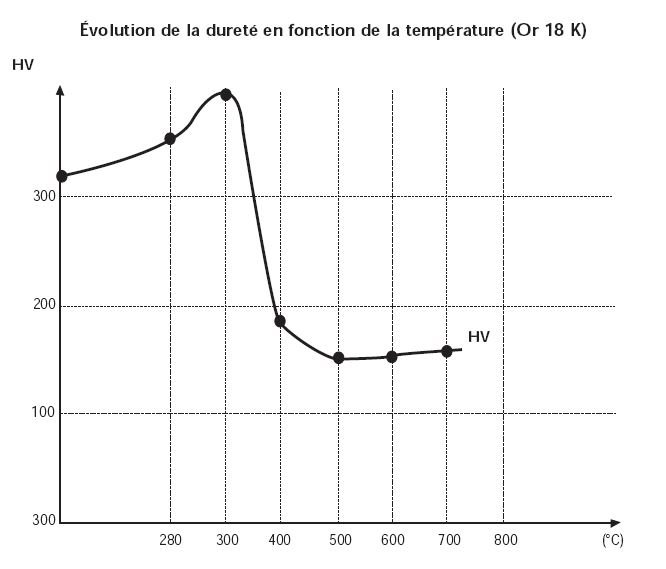
Lorsque l’on refroidit un alliage rapidement par une trempe, on fige les atomes dans la position où ils étaient avant que l’on abaisse la température (1). Comme la solubilité à chaud est plus grande qu’à froid, la structure après trempe contient plus de second élément qu’elle ne devrait. Si on réchauffe correctement l’alliage à la bonne température pendant un temps suffisant, l’élément en surplus va petit à petit se séparer et précipiter pour retrouver la structure dans laquelle il aurait dû se trouver s’il avait eu le temps de se répartir lors d’un refroidissement lent (2). C’est ce qui provoque un durcissement, la dureté des alliages à l’état biphasé étant plus élevée qu’à l’état monophasé (voir figure 1).
Par exemple, un alliage Ag-Cu contenant 5% en poids de cuivre sera constitué d’une solution solide à 750°C.
Si on refroidit cet alliage à 670°C, on atteint la limite de solubilité du cuivre dans l’argent. Le cuivre en surplus commencera à se séparer de l’argent et il se formera des amas de cuivre qui contiendront environ 3% d’argent à cette température.
Au fur et à mesure que l’on continuera à refroidir l’alliage, des amas d’argent de plus en plus pur se formeront à côté d’amas de cuivre de plus en plus pur lui aussi, puisque leur solubilité mutuelle diminue en fonction de la température décroissante.
Cette juxtaposition de matériaux différents rend l’alliage moins souple et donc plus difficile à transformer. Si on veut garder la solution solide, il faut refroidir très vite l’alliage depuis 750°C jusqu’à l’ambiante.
Chaque type d’alliage a sa vitesse de trempe qui lui est propre. Il arrive que de faibles additions d’un autre élément modifie la trempabilité et c’est pourquoi les traitements thermiques sont en général conseillés par les fabricants qui ont mis au point tel ou tel alliage.
Dans les alliages d’or, un phénomène quasiment similaire provoque un durcissement important.
Il s’agit de l’apparition de phases ordonnées qui se produit dans des systèmes qui ont une bonne solubilité mutuelle. (comme dans celui de l’or – cuivre).
A l’état solide, entre 910°C et 410°C l’or et le cuivre sont solubles en toute proportion. Mais on s’aperçoit que si l’on refroidit lentement les alliages contenant moins de 70% en cuivre, il se forme des phases ordonnées dont les atomes sont répartis de façon bien précise. Les phases, de formule Au Cu, dans lesquelles il y a autant d’atomes d’or et d’un plan de cuivre. Ces phases sont très dures car toute tentative de déformer le métal aura pour conséquence de détruire cet arrangement ordonné, ce à quoi l’alliage s’oppose car c’est contraire à sa nature.
Les alliages situés dans ce domaine de concentration sont très cassants.
Si un tel alliage a été trempé, les structures ordonnées n’ont pas le temps de se former et l’alliage et facile à transformer. Par contre, si on le réchauffe ensuite dans le domaine de température situé vers 380°C ces phases se formeront par diffusion et l’alliage deviendra difficile à travailler. Le maximum de phase Au Cu se forme pour une composition de 5% en poids en cuivre, ce qui correspond à l’alliage d’or rouge à 750‰.
Compte tenu des différences de densité entre l’or (19.3) et du cuivre (8.9), cela correspond à un mélange pratiquement équiatomique. Ceci explique les difficultés de fabrication rencontrées avec ces alliages d’or qui nécessitent des trempes énergiques pour garder leur malléabilité.
Du point de vue du praticien
L’ensemble des alliages courants Au-Ag-Cu à 750‰ d’or sont sujets au durcissement structural à des degrés plus ou moins importants.
Plus l’alliage est chargé en cuivre, plus le durcissement est sensible, à tel point qu’un refroidissement lent après recuit d’un or rouge conduira à une précipitation partielle mais suffisante pour provoquer un durcissement.
Pour un or jaune, il faut pratiquer un revenu pour obtenir ce durcissement.
Lors de la fabrication des métaux apprêtés (bande, fil) l’ensemble des traitements thermiques tiennent compte de ces particularités.
Il n’est pas possible de faire des recuits en four à passage sur des alliages rouges par exemple, car le refroidissement est trop lent, ce qui induit la formation de phase ordonnée dure.
Il en est de même pour la fonte à cire perdue lors du refroidissement après coulée.
Un or rouge ou rose, s’il n’est pas refroidi rapidement, durcira. Ceci peut être intéressant sauf pour les mises à taille par expansion (l’alliage sera alors trop fragile et se fissurera).
Le seul moyen sera alors de porter la pièce à une température de mise en solution (préconisée par les fiches alliages Cookson-CLAL), de le refroidir rapidement pour figer la structure monophasée malléable et de réaliser l’expansion.
Les fiches alliages Cookson-CLAL (visible dans la documentation sur chaque fiche produit sur le site) décrivent toujours dans la rubrique PROPRIÉTÉS MÉTALLURGIQUES la potentialité du durcissement structural de l’alliage.
La rubrique TRAITEMENT THERMIQUE indique les températures des traitements avant trempe (mise en solution solide unique) et de revenu (émergence d’une structure biphasée).




